1. 원자의 구조
3. 알켄류와 알킨류
(1) 이온의 생성 - 옥테트 규칙
(2) 화학결합의 생성
1) 이온결합 : 전기 음성도 차이가 1.9 이상
2) 공유결합
(3) 전기 음성도와 화학결합
1) 결합 길이: 공유결합에서 원자 사이의 거리
2) 무극성 공유결합: 전기음성도 차이가 0 인 결합
3) 극성 공유결합: 전기음성도 차이가 0.5에서 1.8 사이인 결합
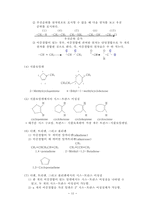
(4) 공유결합 분자와 이온결합 분자의 루이스 구조 그리기- 원자가 전자수 표시
: H2O, NH3, CH4, HCl, C2H4, C2H2, HCHO, H2CO3
(5) 형식 전하: 이온이나 분자에서 원자가 전하를 띠는 것을 형식 전하라고 함.
형식 전하 = 중성 원자의 원자가 전자의 수 - (모든 비공유 전자의 수 +
모든 공유 전자수의 절반
H3O+ 원자가 전자수는 산소가 6개, 수소 원자에서 3개,
루이스 구조식으로 나타내 보면 비공유 전자의 수가 2개, 공유 전자수가 3개
따라서 6 - (2 + 3) = +1 이 된다.
HCO3-에서 중성원자 O의 원자가 전자수는 6개, 비공유 전자의 수가 6개,
공유 전자의 수가 1개, 따라서 6 - (6 + 1) = -1
3. 작용기
(1) 알코올 ( -OH기)
구조식: 에탄올(분자식: C2H6O)
축소 구조식: CH3-CH2-OH 또는 CH3CH2OH
예) C3H8, C4H10
(2) 알데히드와 케톤(C=O를 포함)
예) HCHO, CH3CHO, CH3COCH3
(3) 카르복시산(-COOH기)
예) CH3COOH
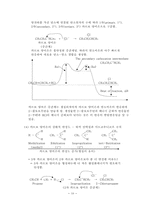
4. 결합각과 분자의 모형
분자들의 루이스 구조를 그리고 원자가-껍질 전자쌍 반발 모형 설명(VSEPR)
VSEPR: valence-shell electron-pair repulsion
메탄(CH4) - 109.5°, 암모니아(NH3) - 107.3°, 물(H2O) - 104.5°
메탄알(HCHO): H-H 116.5°, O-H 121.8°
에텐(C2H4): H-H 117.2°, C-H 121.4°
이산화탄소(CO2): 180°
에틴(C2H2): 180°
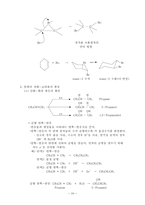
5. 공명




















 분야
분야


