2. 서론
3. Transgene 삽입 과정에서의 조절
[1] ZFN
4. DNA 수준에서의 조절
[1] Promoter
[2] Enhancer/ Insulator
[3] MARs
[4] HDAC inhibitor
5. RNA 수준에서의 조절
[1] WPRE
6. Transgenic animal에서의 이용성
7. 결론
8. Reference
형질 전환 유전자를 삽입하는 방법에는 플라스미드를 사용하는 방법, 바이러스 벡터를 사용하는 방법 등 여러 가지 방법이 존재한다. 이들의 기본적인 원리는 제한효소를 이용하여 본래 존재하던 DNA를 잘라내고 원하는 서열을 넣는 것이다.
기존의 유전자 삽입 방법으로는 제한 효소가 인지하는 base pair가 작았기 때문에 원치 않는 자리에서도 절단이 일어났다. 이로 인해 예상 밖의 DNA서열에서의 유전자 손실, 재배열 등을 야기하여 질병을 가지는 돌연변이를 일으키기도 했다. 이러한 문제를 해결하기 위해서 많은 연구가 진행되었다. 그러한 중에 FokⅠ이라는 제한 효소가 발견되었고 이것을 변형하여 만든 효소가 주목받기 시작했다. Zinc Finger Nuclease라는 인공 제한효소가 바로 그것이다.
[1] ZFN
Zinc Finger는 실험에서 원하는 위치에 정확히 유전자가 삽입되기 때문에 이 방법을 사용할 경우 기존의 다른 방법에 비해 효율이 수천 배 증가한다고 한다. Zinc Finger Nuclease(ZFN)는 FokⅠ이라는 제한효소와 Zinc Finger Protein(ZFP)의 인공 합성으로 만들어진 제한 효소이다. FokⅠ과 ZFP의 구조를 알면 ZFN의 원리에 대해서 쉽게 이해할 수 있다.
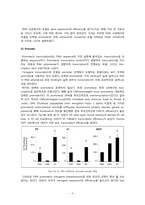
Fig.2 FokⅠ의 구조
FokⅠ은 제한효소의 한 종류로 우리가 많이 알고 있는 제한 효소와는 차이가 있다. 기존의 제한 효소는 인지하는 위치와 절단하는 위치가 같은 반면에 FokⅠ은 인지하는 위치(FR)와 절단하는 위치(FN)가 다르다.(Fig.2) 그렇기 때문에 FokⅠ은 FR부분을 다른 것으로 치환해도 FN부분의 기능에 거의 영향을 주지 않는다. 즉, 다양한 인지 부위를 가지는 제한 효소를 만들 수 있는 것이다.
Zinc Finger Protein(ZFP)은 인간에게는 700개 이상이 존재한다고 밝혀진 단백질인데 30개의 아미노산 사슬로 되어 있고 아연(Zinc) 이온에 의해서 안정화되어 있다. 이 단백질은 3개의 ZFmotif로 이루어져 있는데 각 ZFmotif는 3개의 base pairs와 specific결합한다. 즉, 하나의 ZFP는 DNA major groove(DNA에서 단백질이 잘 붙는 공간)에서 9개의 서열과 결합을 한다.
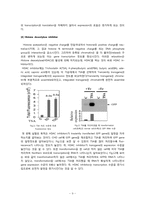
Fig.3 ZFN(Zinc Finger Nuclease)의 구조
ZFN은 FokⅠ의 인지하는 위치를 ZFP로 치환해서 만들며, 두 가지의 큰 특징을 가진다. 첫 번째는 다양한 서열을 인지할 수 있다는 것이다. ZFmotif (5′-NNN-3′)는 64가지(4*4*4)의 서열에 대해서 specificity를 가지고 인지부위는 3개의 ZFmotif로 이루어져 있으므로 ZFmotif가 모두 발견될 경우 최대 4가지의 염기 서열에 대해서 specificity를 가지게 된다. 지금까지 5′-GNN-3′과 5′-ANN-3′은 밝혀졌고 5′-CNN-3′이 대부분 밝혀졌다고 한다.
두 번째 특징은 정확한 위치에서 절단이 일어나게 할 수 있다는 것이다. 지금까지의 제한효소들은 4~6bp정도만 인지할 수 있었기 때문에 하나의 DNA에서 수많은 절단이 일어났다. 그러나 ZFN을 사용할 경우 18bp를 인지할 수 있기 때문에 절단이 많이 일어나지 않고 원하는 위치에서만 절단이 일어나게 할 수 있는 것이다.
ZFN은 single strand만 인지하는 구조를 가지고 있으므로 ZFN에 대한 연구 초기에는 double strand DNA를 cleavage하기에는 좋지 않았다. 그런데 FokⅠ의 구조가 밝혀지고 double strand DNA를 효과적으로 cleavage하기 위해서 dimerization에 대한 연구가 진행되었고 결국 두 ZFN이 4~6bp정도로 떨어져 있으면 최적의 효율이 나온다는 것이 밝혀졌다.
Fig.4 ZFN를 만드는 두가지 방법. (a) 여러 가지 ZFmodule을 assemble하는 방법 (b)context-sensitive selection strategy 방법
ZFN을 이용한 실험은 Cell line이나 초파리, Zebrafish 수준에서는 Gene targeting을 하는 데에는 높은 효율을 보여주었다. 한 연구에서는 사람에게서 severe combined immune deficiency (SCID)을 일으키는 IL2Rg gene의 결함을 cell line 수준에서 높은 효율로 정상 세포로 복구한다는 결과도 있었다. 또한 ZFN기술을 포유동물에 응용하기
[2] 김영혜, 구본철, 권모선, 김태완(2004), “여러 표적세포에서 Retrovirus Vector의 내부 Promoter의 종류와 WPRE의 유무에 따른 GFP유전자의 발현 효율성 비교”, 대구가톨릭대학교 의과대학 생리학교실
[3] 황대연, 조정식, 김용규, 김영상, 백상기, 형질전환동물 기법을 이용한 질환동물모델의 활용, 생명공학 연구지. 2002. pp.56-66
[4] A.J. Clark, A.L. Archibald, M. Mcclenaghan, J.P. Simons, R. Wallace and C.B.A. Whitelaw. Enhancing the effiiency of transgene expression. Phil, Trans. R. Soc. Lond. B. 1993
[5] Bonnine Burgess-Beusse, Catherine Farrell, Miklos Gaszner, Michael Litt, Vesco Muuskov, Fellx Recillas-Targo. The insulation of gene from external enhancers and silencing chromatin. Colloquium
[6] Bruce albert, Essential Cell Biology, 2nd edition, Garland Science. 2005.
[7] Gensheng Mao, Francesco Marotta, Jia Yu, Liang Zhou, Yan Yu, Lina Wang, Dehua Chui. DNA context and promoter activity affect gene expression in lentiviral vectors. ACTA BIOMED. 2008
[8] George C. Allen, Steven Spiker and Willian F. Thompson. Use of matrix attachment regions(MARs) to minimize transgene silencing. Plant Molecular Biology 43. 361-376, 2000.
[9] Ileana Popa, Matthew E. Harris, John E. Donello, and Thomas J. Hope(2002), "CRM1-Dependent Function of a cis-acting RNA Export Element", MOLECULAR AND CELLULAR BIOLOGY pp.2057-2067.
[10] Klug, Cummings, Spencer, Palladino. "Concepts of Genetics Ninth Edition". Pearson. 2009
[11] Kristin S.Scott and Pamela K.Geyer, Effects of the su(Hw) insulator protein on the expression of the divergently transcribed Drosophila yolk protein genes. The EMBO Journal, Vol.14
[12] Kyung-hwan Han, Caiping Ma and Steven H. Strauss. Matrix attachment regions (MARs) enhance transformation frequency and transgene expression in poplar. Transgenic Research 6, 415-420(1997)
[13] Luo Y, Jian W, Stavreva D, Fu X, Hager GL, Bungert J, Huang S, Qiu Y. Trans-regulation of histone deacetylase activities through acetylation. J Biol Chem. 2009 Oct 11
[14] Matthew H Porteus외 4명, Comparison of Zinc Finger Nucleases for Use in Gene Targeting in Mammalian Cells, 2008.
[15] O.G. Maksimenko, D.A. Chetverina, and P.G. Georgiev. Insulators of higher eukaryotes : Properties, Mechanisms of Action, and Role in Transcriptional Regulation. Institute of Gene Biology, Russian Academy of Sciences. 2006
[16] Parker R, Sheth U(2007), "P Bodies and the Control of mRNA Translation and Degradation", Molecular Cell pp.635–646.
[17] Reinhar Klein, Barbel Ruttkowski, Elzbieta Knapp, Brian Salmons, Walter H. Gunzburg, Christine Hohenadl(2006), "WPRE-mediated enhancement of gene expression is promoter and cell line specific", SCIENCE DIRECT Gene pp.153-161.
[18] Ricki Lewis, Bruce Parker, Douglas Gaffin, Marielle Hoefnagels(2009), LIFE 6th Edition, Life Science pp.249-250
[19] Sangmi Chung, Therese Andersson, Kai-C. Sonntag, Lars Bjorklund, Ole Isacson, Kwang-soo Kim. Analysis of Different Promoter Systems for Efficient Transgene Expression in Mouse Embryonic Stem Cell Lines. Stem Cells. 2002
[20] Sims RJ 3rd, Mandal SS, Reinberg D, "Recent highlights of RNA-polymerase-II-mediated transcription", Current opinion in cell biology. Jun 2004. pp.263–271.
[21] T Higashimoto, F Urbinati, A Perumbeti, G jiang, A zarzuela, L-J Chang, DB kohn and P Malik (2007), "The woodchuck hepatitis virus post-transcriptional regulatory element reduces readthrough transcription from retroviral vectors", Nature pp.1298-1304
[22] Toni Cathomen, J Keith Joung, Zinc-finger Nucleases: The Next Generation Emerges, 2008.
[23] Urnov, F. D. et al. Highly efficient endogenous human gene correction using designed zinc-finger nucleases. 2005.
[24] Watson, Gilman, Witkowski, Zoller. Recombinant DNA, W.H. Freeman and company, 1992.
[25] Xinsheng Nan, Laura Hyndman, Nike Agbi, David J. Porteous, A. Christopher Boyd. Potent stimulation of gene expression by histone deacetylase inhibitors on transiently transfected DNA. Biochemical and Biophysical Research Communications 324 (2004) 348-354
















 분야
분야


