Principle:
1. Signal transduction
2. Western Blotting
3. Lysis buffer
4. Bradford Assay
5. protein sample buffer 구성
6. 단백질을 boiling하는 이유
7. Acrylamide gel 만들기
8. Electrophoresis
9. Constant voltage/current?
10. Transfer.
11. Blocking
12. Primary antibody treatment
13. Secondary antibody
14. ECL solution
15. Film development
< Day 1 >
[Acrylamide gel 만들기 (10%-X2)]
Apparatus:
Reagent:
Procedure:
[Protein determination]
Apparatus:
Reagent:
Procedure:
< Day 2 >
[Blocking]
[Primary antibody incubation]
< Day3 >
[Secondary antibody]
[Protein staining]
Discussion:
- Bradford Reagent는 95% ethanol, 88% phosphoric acid, Brilliant Blue G로 이루어져 있다. Ethanol은 유기용매이기 때문에 coomassie blue를 Bradford reagent 내에 잘 용해 시키고, phosphoric acid는 reagent가 산성 조건을 충족시키게 한다. 산성 조건 하에서 Coomassie blue는 doubly-protonated red form이 되기 때문에 6개의 phenyl group들과 2개의 sulfonic acid group들이 공격성을 가지게 되어 단백질과 결합하는데 소수성 결합 (hydrophobic interaction with Try, Tyr, His, Phen)과 반데르발스 결합 (electrostatic force with Arg and Lys)을 통해 결합을 한다. Arg에 반응하는 양이 aromatic ring을 가진 아미노산 잔기보다 8배정도 높다.
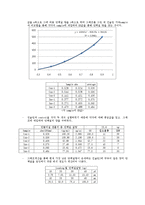
- UV-Visible spectrophotometer를 이용, 흡광도를 측정하여 기준 물질인 BSA(Bovine Serum Albumin)나 BGG(Bovine Gamma Globulin)를 기준으로 자신의 시료에 단백질이 얼마만큼 들어있는지 측정하는 방법 중 하나. 빠르고 간편하게 단백질을 정량 할 수 있다.
- Dye로는 Coomassie Blue G-250를 사용하며, 이 dye가 단백질과 결합해 생기는 파장의 변화를 측정한다. 산성 조건 하에서 단백질은 Coomassie dye에 결합하는데 이 결과로 reddish/brown form(465nm에서 최대 흡광)이던 dye는 푸른 형태(610nm에서 최대 흡광)으로 스펙트럼 이동이 일어나게 된다. 두 가지 형태의 차이는 595nm에서 최대가 되는데, 따라서 이 파장이 Coomassie dye-protein complex의 푸른 형태를 측정하는데 최적의 파장이 된다. 575nm~615nm사이의 어느 파장에서든 blue form을 측정할 수는 있지만 595nm에서 측정한 것보다 측정되는 흡광도 값이 10%정도 낮아지게 된다.
- Bradford protein assay에서 Coomassie dye ligand는 단백질의 positive charged된 부분에 결합하기 때문에 basic amino acid인 arginine, lysine, histidine잔기가 필요하다. (주로 dye와 작용하는 amino acid는 arginine이다) 또한 Dye-protein complex를 형성하기 위해 van der Waals, hydrophobic interaction도 작용하며, 단백질의 크기 또한 영향을 미친다. 일반적으로 3000Da 미만의 단백질은 Bradford assay로 정량 할 수 없다.
- Bradford assay는 실온에서 사용가능하며, 어느 특별한 장비를 필요로 하지 않는다. (Spectrophotometer, cuvette, dye정도가 필요하다) 어느 단백질이든 동일한 dye를 더해준 후 약 5분 정도 반응시키고, 595nm에서 흡광도를 측정하기만 하면 되는 간단한 방법이지만, 대신 Coomassie dye가 염, detergent, 지방 등에 의해 쉬이 영향을 받는다는 단점이 있다. 특히나 sample에 계면 활성제(surfactant)가 조금이라도 존재하는 경우, 정량 값이 크게 영향을 받게 되는데, 이는 dye로 사용하는 Coomassie blue가 acidic하기 때문이다. 단백질에 따라 Coomassie dye와 결합하는 정도도 조금씩 다를 수 있으므로 주의가 필요하다. 이런 발색을 이용한 단백질의 정량은 시간이 지날수록 결과값이 달라지는 경우가 생기기 때문에 되도록 빠른 시간 내에 시행해야 한다.
- 단백질의 정량을 위해서는 standard가 필요한데, BSA(Bovine Serum Albumin)나 BGG (Bovine Gamma Globulin)를 이용해 standard curve를 얻을 수 있다. 여러 농도의 BSA or BGG(반드시 0농도를 포함해야 한다)를 만들어 dye를 넣은 후 반응시켜 595nm에서 흡광도 측정을 하고 그 결과값을 이용해 standard curve를 그린다. 이 때 curve는 직선형에 가까울수록 신뢰도가 높아진다. 그런 다음 정량 하고자 하는 단백질이 든 sample을 dye처리해 흡광도를 측정해 BSA(or BGG)의 값과 비교해보면,





















 분야
분야


