2. 실험이론
A. Fick’s Law of Diffusion
B. Einstein Relation and Nernst-Einstein Equation
3. 실험방법
A. 실험시약
B. 실험기기
C. 실험방법
4. 실험결과
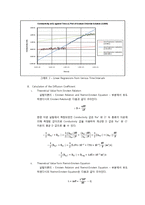
A. Graphical Interpretation of Raw Data
B. Calculation of the Diffusion Coefficient
i. Theoretical Value from Einstein Relation
ii. Theoretical Value from Nernst-Einstein Equation
iii. Experimental Value and Error
5. 실험토론
A. Data Analysis and Interpretation of Results
B. Derivation of the Experimental Diffusion Equation
C. Error Analysis
i. Effect of Stirring on Diffusion
ii. Relaxation Effect and Electrophoretic Effect
iii. Temperature Deviation
iv. Failure of the Experimental Diffusion Equation
6. 결론
7. 참고문헌
실생활에서 이루어지는 대부분의 화학공정은 유체 상태의 반응물을 기초로 이루어진다. 이는 유체의 균질성 및 비교적 편리한 활용성에 의한 경우가 많으며 이외에도 유체의 여러 가지 성질은 공정의 모델 및 설계에 큰 영향을 주는 변수가 된다. 한편 이러한 유체의 성질 중 가장 핵심적인 것 중 하나는 바로 유체의 확산도라고 할 수 있다. 반응공학 자체가 물질의 변화와 분포에 초점이 맞춰져 있는 만큼 유체의 분포를 결정짓는 확산도는 반응설계에 있어서 절대로 빠져서는 안 되는 필수불가결한 요소 중 하나아다. 이번 실험에서는 2M 수용액에서 NaCl의 확산상수를 결정함으로 확산상수의 의미를 살펴보기로 한다.
실험이론
Fick’s Law of Diffusion
물질의 확산은 1855년 Adolf Fick에 의해 유도된 Fick’s Law 를 따르며 이는 다음과 같이 표현된다.
J= -D ∂C/∂x
∂C/∂x= Concentration gradient in the x-direction [M/s]
J=Diffusion flux across unit are at right angles to the x-direction [ mol/(s∙cm^2 )]
D=Diffusion constant [ cm^2/s]
여기서 – 부호는 흐름이 높은 농도에서 낮은 농도로 일어남을 나타내준다. 한편 위의 Fick’s Law 식을 보면 시간에 따른 농도의 변화는 없다는 것을 알 수 있다. 시간에 따라 농도가 변하는 non-steady state은 Fick’s Second Law에 의해 표현되며 Second Law는 First Law 와 물질수지에 의해 유도될 수 있다.
B. Atkins, de Paula. “Atkins’ Physical Chemistry” 8th ed. Oxford University Press, 2006.
C. Bennett Myers, "Momentum, Heat and Mass Transfer",3rd ed., McGraw-Hill,1983.
D. Morton M. Denn, "Process Fluid Mechanics", Prentice-Hall, Inc.,1980.
E. R. Byron Bird, Warren E. Stewart and Edwin N. Lightfood, "Transport Phenomena", JOHN WILEY & SONS, 1960.
F. Willian M. Deen, " Analysis of Transport Phenomena", Oxford University Press,1998.
G. W.L Mc Cabe and J.C. Smith, "Unit Operation of Chemical Engineering", 3rd ed., McGraw-Hill, 1976.
















 분야
분야


