2. Date, Temperature, Humidity
4. Principle & Object
5. Reagent
6. Apparatus & Instrument
7. Procedure
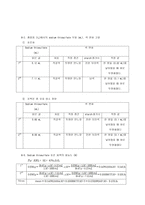
8. Result
9.Discussion
10. Reference
11. Homework
요오드 적정법(iodometric titration)
요오드 적정법으로 알려진 요오드 계측법은 체적 화학 분석법으로, 요오드 원소의 출현 또는 소실이 종말점을 나타내는 산화-환원 적정법이다.
Iodometry는 분석물과의 반응으로 유리 된 요오드의 간접 적정을 포함하는 반응인 반면에, iodimetry는 적정액으로 요오드를 사용하는 직접 적정 방법을 말한다. 환원제로서 sodium thiosulfate (Na2S2O3)를 사용하는 산화-환원 적정법은 요오드를 적정하기 위하여 특별히 사용되기 떄문에 요오드 적정으로 알려져 있다.iodometric 적정법은 용액에서 산화제의 농도를 결정하는 일반적인 방법이다. 요오드 적정에서 사용되는 전분 용액 (starch)는 방출되는 I2를 흡수할 수 있기 때문에 지시약으로 사용되는 것이다. 이 흡수는 표준화 된 thiosulfate 용액으로 적정할 때 용약이 옅은 황색에서 진한 파란색으로 변하는 원인이 된다. 이는 적정의 종말점을 나타낸다. Iodometry는 일반적으로 생태학 연구에서 산소 포화도 또는 수영장 물 분석에서 활성 염소와 같은 물 표본의 산화제 농도를 분석하는 데 사용된다.
2) Basic 고교생을 위한 화학 용어사전, 서인호, 신원문화사, 2002.09.30 (2019-05-23 검색)
3) 화학백과, 대한화학회 (2019-05-23 검색)
4) 화학용어사전, 윤창주, 일진사, 2011.01.15 (2019-05-23 검색)
5) http://msds.kosha.or.kr/ - Distilled water (2018-04-02 개정), (2019-04-05 검색)
6) http://msds.kosha.or.kr/ - sodium thiosulfate pentahydrate (2018-12-20 개정), (2019-05-23 검색)
7) http://msds.kosha.or.kr/ - Sodium carbonate (2018-04-02 개정), (2019-05-23 검색)
8) http://msds.kosha.or.kr/ - Hydrochloric acid (2018-10-27 개정), (2019-05-23 검색)
9) http://msds.kosha.or.kr/ - Potassium iodate (2018-04-02 개정), (2019-05-23 검색)
10) http://msds.kosha.or.kr/ - Potassium iodide (2018-04-02 개정), (2019-05-23 검색)
11) http://msds.kosha.or.kr/ - Calcium hypochlorite (2018-04-02 개정), (2019-05-23 검색)
수업시간에 조교님께서 피드백 해주신 부분을 다시 수정해서 올렸습니다.
계산 과정 식, 그래프 모두 있습니다.














 분야
분야


