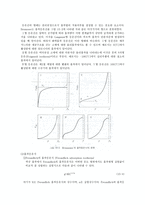
휘발성 차이를 이용(비점의 차이에 의해)하여 액체혼합물로부터 각 성분을 분리하는 조작을 증류라고 한다. 혼합물중의 두 성분이 모두 휘발성분인 점에서 한쪽성분이 휘발성인것과는 구분된다. 일반적으로 증기압이 큰 성분 즉 비점이 낮은 성분이 휘발하기 쉽다. 따라서 증류에서는 각 성분의 증기압이 분리의 척도가 된다.
1)기체 - 액체의 평형관계
①Raoult법칙
액체 혼합물에서 한 성분이 나타내는 증기압은 그 온도에서 2성분이 단독으로 존재할 때 나타내는 증기압에 용액 중에 존재하는 2성분의 몰분율을 곱한 것과 같다. 이것을 Raoult의 법칙이라 한다. 특정 온도에서 혼합물 중 한 성분의 증기분압은 그 성분의 몰 분율에, 같은 온도에서 그 성분의 순수한 상태에서 나타내는 증기압을 곱한다.
(액체일 경우 Raoult의 법칙이 성립한다. )
P = P+P= P+P
P=P , P= P
P,P= 저비점과 고비점 성분의 증기분압
P, P = 각 성분의 순수상태의 증기압
기상에 있어서는 Dalton의 법칙이 성립된다고 하면 증기 중의 성분 A인 몰분율인 y는 전압에 대한 A의 분압의 비와 같으므로 다음식으로 나타낸다.
y = =






















 분야
분야


