실험 2 : 증발접시에서 마그네슘 연소시키기
실험 3 : 도가니에서 마그네슘 연소시키기
최종 결과 해석
오늘날 사람들은 연소가 물질이 산소와 결합하며 빛과 열을 내는 현상이라는 것을 알고 있다. 하지만 예전에는 연소에 대해 플로지스톤설이 가장 유력한 이론으로 받아들여졌다. 이 설은 17~18세기 무렵에 화학현상을 설명하는 데 있어 지배적인 지위를 차지했던 가설(假說)로 이 이론에 따르면 플로지스톤은 가연성(可燃性)을 대표하는 원소이며 가소물질이나 금속은 모두 이것을 함유하며 연소란 원래의 물질에서 플로지스톤이 빠져 나가고 뒤에 재만 남는 현상이라 설명한다. 금속의 산화도 같은 원리로서 설명한다. 플로지스톤설은 화학현상을 통일적으로 설명하는 최초의 이론인 데다가 옛날부터 내려오는 4원소의 개념 중에서 불의 원소와 일맥상통하여 18세기 중엽에는 일세를 풍미하였다. 슈탈은 연소를 설명하기 위해 플로지스톤을 생각했었지만, 나중에는 플로지스톤이 모든 화학이론의 중심이 되고, 굳기와 색의 원인으로까지 확대하였다. 이 가설은 근대적인 연소이론을 세운 A. L. 라부아지에에 의해서 1783년에 완전히 부정되었다. 라부아지에는 기존의 플로지스톤설을 일축하는 실험을 하여 새로운 연소 이론을 확립하였다. 그는 밀폐된 용기 내 수은을 넣고 연소반응을 하였다. 그 결과 연소 전이나 후의 질량이 변하지 않은 채로 유지되는 것을 확인하였다. 연소란 플로지스톤이 빠져나가는 것이 아니라 산소와 물질이 결합하는 것으로 반응 전후의 질량은 변하지 않는다는 오늘날의 연소반응이론을 만들었다.
라부아지에의 반론에 플로지스톤 신봉자들은 플로지스톤은 음의 무게를 가지며 플로지스톤이 빠져나간다는 것은 -(-X ) 즉 +( X )이 되어 연소할 때 질량이 증가하는 현상을 설명하였다. 따라서 오늘 실험에서는 플로지스톤 이론을 반박하기 위해 물질이 연소할 때 질량이 증가하는 현상과, 이 때 결합하는 물질이 산소라는 것을 증명하기 위한 실험을 전개할 것이다.
마그네슘 연소 실험
◎ 공기 중에서 마그네슘 연소시키기.
실험 1 : 연소 후의 마그네슘에서 산소 확인하기.
연소 후 마그네슘을 물에 녹인 뒤 페놀프탈레인 용액을 떨어뜨려 액성을 알아본다. 만약 연소에서 마그네슘이 산소와 결합하여 산화마그네슘이 되었다면 물에 녹았을 때 염기성을 띠게 될 것이다.
MgO(s) + H2O(l) → Mg(OH)2(aq)
실험 기구 및 시약 : 마그네슘 리본 0.1g, 집게, 모래상자, 토치, 보안경
실험 순서
마그네슘 리본 약 10cm를 모래상자에 고정시킨다.
토치로 마그네슘 리본 끝을 가열하여 불을 붙인다.
연소가 끝난 후 마그네슘을 페트리접시에 모아 물을 붓는다.






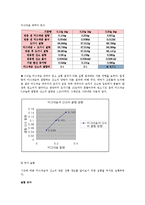
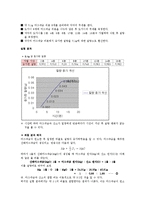



 분야
분야


