2. 왜 Critical point가 물질마다 다를까?
3. Application of Supercritical fluid
4. 참고문헌
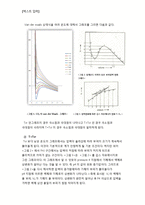
1. Critical point & Supercritical fluid
한 물질의 기체상과 액체상을 매우 강한 밀폐 용기에 넣고 온도와 압력을 동시에 증가시킨다. 온도와 압력이 커져감에 따라 기체의 밀도는 점차 증가하게 되고 액체의 밀도는 감소하게 된다. 이렇게 기체의 밀도가 증가하고 액체의 밀도가 감소하다보면 특정한 임계점에서는 기체와 액체의 밀도가 동일해진다. 이 지점을 이 물질의 Critical point라고 한다. 이 지점의 온도가 Critical Temperature, 압력이 Critical Pressure이다.이 지점에서는 압력을 더 가하거나 온도를 더 가하더라도 기화, 액화가 되지 않는다. Critical Point에서는 물질의 액체상과 기체상의 경계가 사라진 상태가 되며 이러한 물질을 Supercritical fluid라고 한다. Supercritical fluid의 기본적인 특성은 기체처럼 확산이 잘되며 액체처럼 다른 액체나 고체를 용해시키는 용해력이 좋다.
2. 왜 Critical point가 물질마다 다를까?
Pc/atm Vc/(cm3mol-1) Tc/K
Ar 48.00 75.25 150.72
CO2 72.85 94.0 304.2
C2H4 50.50 124 283.1
Cl2 76.1 124 417.2
H2 12.8 64.99 33.23
O2 50.14 78.0 154.8
H2O 218.3 55.3 647.4
Critical point는 위의 표에서 볼 수 있듯이 물질의 종류에 따라 각각 다르다. critical point가 물질마다 다른 이유를 설명하기 위해서는 먼저 Critical point가 어떻게 정해지는지를 알아야 한다.
(2) David R. Gaskell, 재료열역학, 홍릉과학출판사, 2009
(3) Peter Atkins, Physical chemistry, Oxford, 2006








 분야
분야


